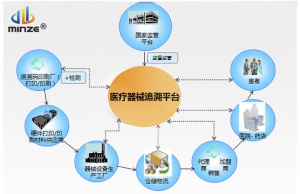
医疗器械上市后,尤其是高风险的医疗器械的追溯管理、监督是全球性的难题。为消除隐患,从患者的安全着想,医疗器械的安全性是最优先的考虑对象。唯一器械标识(UDI, Unique Device Identification) 已经被认为是一个改善患者结果的重要工具,同时实现更高效的召回过程,减少医疗事故,提高库存透明度和供应链安全性。
2013年9月23日,美国食品药品监督局(FDA)正式出台了举世瞩目的医疗器械监管规则:所有在美国销售的医疗器械必须标注UDI,几乎“一夜之间”,不仅美国本土的制药企业需要在自己的包装线上配备UDI标识与数据系统,UDI系统也成为全球众多国家纷纷仿效的终极手段。
UDI解决方案
唯一器械标识(Unique Device
Identification,缩写UDI)是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。全球采用统一的、标准的UDI有利于提高供应链透明度和运作效率;有利于降低运营成本;有利于实现信息共享与交换;有利于不良事件的监控和问题产品召回,提高医疗服务质量,保障患者安全。